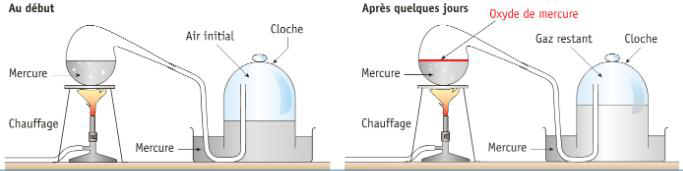
Lavoisier chauffe fortement pendant plusieurs jours du mercure dans une cornue. Il recueille de l’oxyde rouge à la surface du mercure et constate que le volume d’air de la cloche (à droite sur le dessin) a diminué de 0,14 litre. Le gaz restant dans la cloche ne permet plus la combustion d’une bougie et fait mourir une souris. Il l’appelle «azote » ce qui signifie « sans vie ». Ce gaz prendra ensuite le nom de diazote.
Dans un deuxième temps, il place l’oxyde de mercure dans une autre cornue et le chauffe : il récupère ainsi du mercure et 0,14 litre d’un gaz , »l’air vital », qui stimule la flamme d’une bougie et permet la respiration de la souris. Lavoisier renomme l'«air vital » en oxygène en 1777 à partir de la racine grecque oxys (acide, littéralement "âpre" d'après le goût des acides et gen?s (producteur, littéralement « qui engendre »). On l’appellera ensuite dioxygène.
En mélangeant ce nouveau gaz avec celui restant sous la cloche après la première opération, il retrouve le même volume d’air qu’au départ, soit 0,8 litre, et constate que ce mélange de gaz se comporte comme l’air : il n’éteint pas les lumières et ne fait pas périr les animaux.
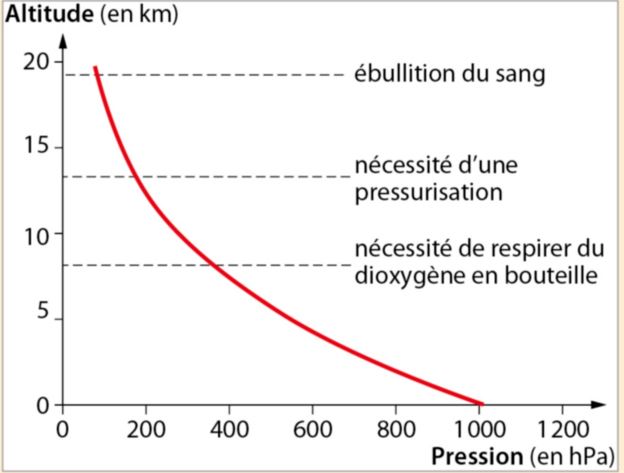
 Diagramme :
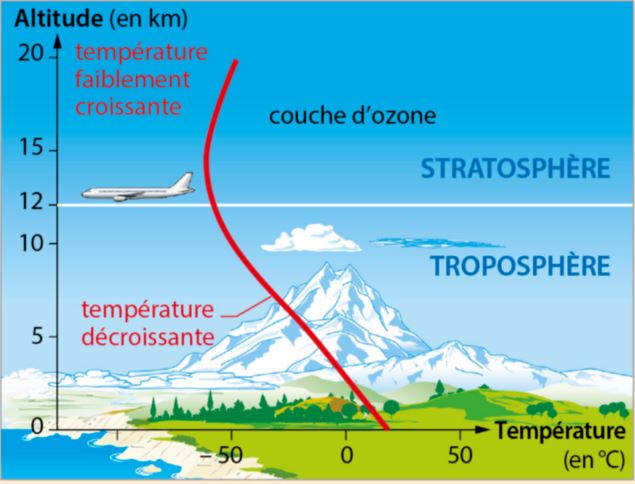
Diagramme :